Sistemi chimicamente omogenei
E’ fondamentale conoscere questi sistemi per avere un’idea di come funzionano
gli impianti di servizio, come ad esempio tutti quegli impianti che utilizzano fluidi per generare calore o lavoro.
Cominciamo analizzando un sistema chiuso, cioè un sistema nel quale si conserva la quantità di massa interna e avvengono scambi solo a livello energetico di calore e lavoro.
Fig. 1 Sistema chiuso
In particolare consideriamo quei sistemi costituiti da sostanze pure cioè sostanze che pur mantenendo la stessa composizione chimica si presentano nelle diverse fasi. A causa della sua facile reperibilità nei diversi stati di aggregazione a temperatura ambiente, il sistema chimicamente omogeneo più studiato è l’acqua.
L’acqua può assumere ognuno dei tre diversi stati fisici della materia:
SOLIDO Þ GHIACCIO
LIQUIDO Þ ACQUA
GASSOSO Þ VAPORE O GAS D’ACQUA
Per definire gli stati di una sostanza in un sistema chimicamente omogeneo una volta chiarito l’elemento si utilizzano tre grandezze:
- p intesa come pressione assoluta ( Pascal ) e non come differenza di pressione rispetto all’ambiente.
- v volume specifico inteso come
![]()
![]()
(1)
-
T
temperatura assoluta espressa in gradi Kelvin.
Conoscendo queste tre grandezze posso determinare lo stato termodinamico del sistema. Ma non essendo queste completamente indipendenti l’una dall’altra, è importante stabilire il numero minimo di parametri indipendenti necessari a definirne3 lo stato.
Per fare ciò dobbiamo far riferimento alla cosiddetta regola delle fasi di Gibbs. La regola ci dice che i gradi di libertà del sistema (del diagramma termodinamico) possono essere descritti dalla seguente equazione:
P = M – F + 2
(2)
dove
P è il numero di gradi di libertà, M è il numero di componenti chimiche che
compongono il sistema e F è il numero di fasi presenti.
- Quando c'è soltanto una fase presente
cioè P = 2 (es: solo liquido). p,T possono essere variate
indipendentemente, e la singola fase è rappresentata da un' area del
diagramma termodinamico.
- Se due fasi coesistono, per esempio
liquido e vapore, e sono in equilibrio cioè P = 1, fissata la temperatura,
la pressione è automaticamente determinata. L’ebollizione, ad esempio, a
una certa pressione avviene a una certa temperatura.
3. Se
tre fasi coesistono allora P = 0, non ho più gradi di libertà e il punto
è univocamente determinato sul diagramma termodinamico rappresentato dal punto
triplo.
E’ quindi possibile affermare che per un sistema ad un componente e ad una fase che si trova in condizione di equilibrio esiste sicuramente un’equazione che lega tra loro le tre coordinate termodinamiche pressione, volume specifico e temperatura.
Diagramma termodinamico ( p,v,T )
Per illustrare i passaggi delle sostanze da una fase di aggregazione all’altra sono presi in considerazione i diagrammi tridimensionali p,v,T , cioè diagrammi cartesiani in cui sui tre assi vengono riportate le tre grandezze di riferimento fondamentali.
Sull’asse X il volume specifico, sull’asse Y la temperatura , sull’asse Z la pressione assoluta.
Ad ogni terna di valori p, v, T corrisponde un punto nella rappresentazione grafica. Se noi andiamo a tracciare punto per punto anche misurando sperimentalmente, troveremo un piano di complessità più o meno variabile che passa per tutti i punti che definiscono le proprietà e gli stati fisici del sistema.
Prendendo in considerazione il diagramma termodinamico dell’acqua risulta evidente che, contrariamente a quanto succede per la maggior parte delle sostanze, questa aumenta di volume nel passaggio dalla fase liquida a quella solida e la fusione avviene a temperature tanto più basse quanto maggiori sono le pressioni.
Sulla superficie (p, v, T) si distinguono tre regioni Solido, Liquido e Gassoso caratterizzate dalla presenza di una sola fase; in ciascuna di queste regioni lo stato fisico è determinato da due qualsiasi delle tre coordinate mentre la terza è deducibile dalle prime due. All’interno della campana coesistono invece due stati: Solido-Liquido, Solido-Gassoso, Liquido-Gassoso; qui la pressione e la temperatura non sono indipendenti tra loro, per cui lo stato fisico del sistema è definito univocamente solo dalle coppie pressione-volume specifico o temperatura-volume specifico.
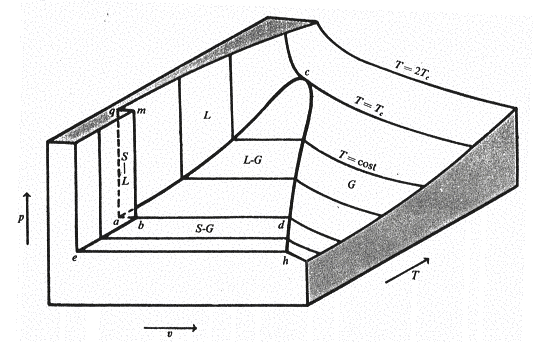
Fig. 2 Diagramma termodinamico (p, v, T) dell’acqua
Dalla proiezione di tale diagramma sui piani cartesiani vengono ottenuti i diagrammi bidimensionali ( p, T ) e ( p, v ), più facili da rappresentare e importanti concettualmente. Da un punto di vista pratico, solo le zone caratterizzate dalla presenza degli stati Liquido e Gassoso sono rilevanti ai fini della rappresentazione dei cicli termodinamici. Tralasciamo la proiezione sul piano ( T, v ) perché di scarso interesse.
Diagramma termodinamico ( p, v )
Il
diagramma assume un andamento a campana detta Campana di Andrews.
Sull’asse delle X abbiamo il volume specifico ( v ) in ![]() , sull’ asse Y la pressione ( p ) in Pascal
o Atm.
, sull’ asse Y la pressione ( p ) in Pascal
o Atm.
Nelle rappresentazioni il diagramma non ha scala lineare ed è molto deformato rispetto all’andamento reale. E’ una rappresentazione didattica semplificata al fine di rendere concettualmente più chiaro il grafico.
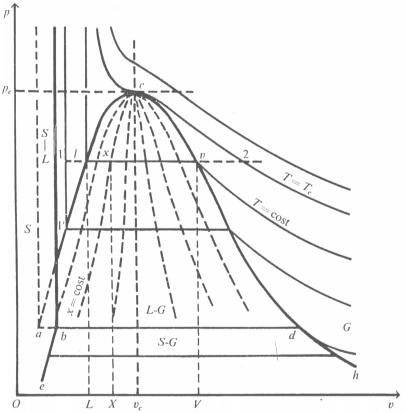
Fig. 3 Diagramma termodinamico (p, v) dell’acqua
Avendo
riassunto un diagramma tridimensionale in due dimensioni abbiamo perso
un’informazione, cioè quella della temperatura. Tale parametro viene
rappresentato graficamente attraverso una serie di curve con tendenza
parabolica dette Isoterme che identificano i vari stadi a temperatura
costante. Osservando tali curve da sinistra verso destra notiamo, nella fase
liquida, un’andamento quasi verticale. In corrispondenza dell’incrocio con la
campana, nella zona liquido-vapore, le trasformazioni isoterme sono anche a
pressione costante e pertanto sono rappresentate da segmenti di retta paralleli
all’asse delle ascisse. Usciti da questa fase, nella fase gassosa tornano ad
avere un andamento parabolico.
Procedendo verso l’alto la temperatura definita dalle isoterme aumenta, fino a raggiungere il valore di 374° K identificato dalla curva tangente alla campana nel Punto Critico C. Tale curva viene perciò definita Isoterma Critica. Il punto C divide la campana di Andrews, che descrive gli stati fisici dove possono coesistere Liquido e Vapore, in due parti: quella di sinistra definita Curva limite inferiore rappresenta la fase di solo Liquido o Vapor saturo; l’altra, detta Curva limite superiore, definisce lo stato di Vapore o Vapor saturo secco.
Ad una temperatura superiore a 374° K si parla di gas, con un comportamento simile a quello dei gas ideali, e non di vapore poiché oltre a questo valore non si ha più la possibilità di passare dallo stato gassoso a quello liquido solo aumentando la pressione.
Considerato uno stato all’interno della campana, quindi in presenza sia di Liquido che di Gas, è opportuno definire la grandezza Titolo ( x ) come rapporto tra la massa del vapore e quella del sistema:
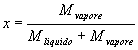
(3)
Il titolo sarà un valore crescente compreso tra 0 e 1 in quanto
- Curva limite inferiore Þ x = 0
- Curva limite superiore Þ x = 1
Posso
tracciare all’interno della campana curve a titolo (x) costante che assumono un
andamento a raggiera dette Curve Isotitolo.
In presenza di più fasi ( Liquido e Vapore ) il volume specifico cambia assumendo il significato di volume medio. Con volume medio intendo il volume specifico di una sostanza come il suo volume diviso la sua massa:
![]()
(4)
Dividendo entrambi i membri per (![]() ) si ottiene :
) si ottiene :
![]()
(5)
da questa posso ricavare il titolo in funzione dei volumi:
![]()
(6)
se intendo con volume differenziale la seguente differenza:
![]()
(7)
posso scrivere la (6) come:
v(x) ![]()
![]()
(8)
In modo analogo possiamo definire altre grandezze come:
Energia interna Þ ![]() (9)
(9)
Entalpia Þ ![]() (10)
(10)
Entropia Þ ![]() (11)
(11)
Ha particolare importanza la grandezza hd , spesso tabulata con la lettera r, intesa come calore latente di vaporizzazione necessario per trasformare 1 kg d’acqua liquida in 1 kg di vapore.
Comportamento
dell’acqua durante i passaggi di stato a pressione ambiente
Il passaggio da uno stato ad un altro avviene mediante somministrazione o sottrazione di calore che altera lo stato di equilibrio in cui il sistema eventualmente si trova. In generale, fornendo calore ad una qualsiasi sostanza si va ad accrescere l’energia cinetica delle sue particelle aumentandone lo stato di agitazione termica. Se l’energia acquistata dalle molecole è sufficiente a vincere determinati legami molecolari, si ha il passaggio della sostanza da uno stato di aggregazione ad un altro caratterizzato da una minore densità. Contrariamente, se a un corpo viene sottratto calore il procedimento descritto avviene nella direzione opposta.
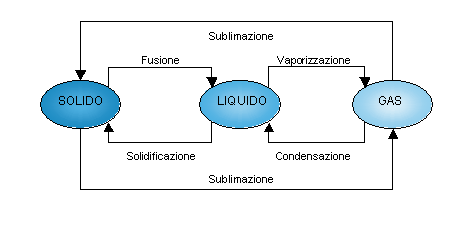
Fig.4 Schema dei
passaggi di stato dell’acqua
Prendiamo un blocco di ghiaccio inserito in un contenitore e forniamogli del calore. Riportiamo i dati dell’esperienza in un grafico ponendo sull’asse delle ascisse le corrispondenti temperature T (° C), sull’asse delle ordinate il tempo t (s) proporzionato al calore somministrato e alla massa del blocco.
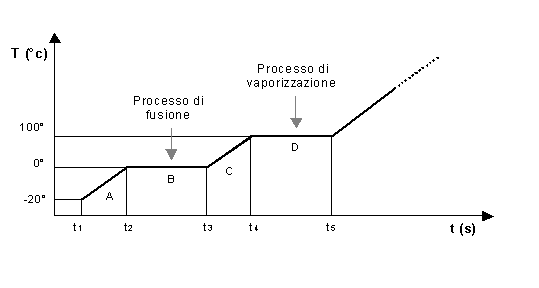
Fig. 5 Andamento
tipico della temperatura in funzione della quantità di calore
somministrata
ad un blocco di ghiaccio in un certo tempo
Inizialmente il blocco è allo stato solido ad una temperatura pari a –20°C, fornendogli calore si ha un aumento della temperatura. Raggiunti gli 0° C inizia il passaggio di stato da solido a liquido e la temperatura rimane costante durante tutta la fusione. Successivamente la temperatura continua ad aumentare fino a raggiungere i 100 °C dove inizia il processo di vaporizzazione. Anche in questa seconda fase la temperatura si mantiene costante per poi tornare ad aumentare ancora a fase conclusa.
La temperatura si mantiene costante durante tutta la fase di passaggio da uno stato di aggregazione ad un altro in quanto la quantità di calore che si continua a fornire non serve a far aumentare la temperatura ma a compiere un lavoro per vincere i legami molecolari, questo fino a quando tutta la massa non ha subito il passaggio di stato, dopodiché la temperatura riprende a crescere in modo proporzionale alla quantità di calore somministrata. Chiamiamo tale calore calore latente.
Riportiamo alcuni valori di calori specifici e calori latenti relativi alla nostra esperienza nelle diverse fasi:
-
Fase A ( Solido )
Þ Cp = 1.900 ![]()
-
Fase B ( Solido-Liquido ) Þ Cl
= 1.600.000 ![]()
-
Fase C ( Liquido ) Þ Cp = 4.187 ![]()
-
Fase D ( Liquido-Vapore ) Þ Cl = 2.257.000 ![]()
Determinato un qualsiasi valore di pressione tale comportamento resta pressoché invariato.
Se però consideriamo un liquido a pressione costante ma molto elevata e ne aumentiamo la temperatura, notiamo che si ha un passaggio diretto allo stato gassoso, non si parlerà più quindi di calore latente e percentuale di acqua e vapore in quanto il cambiamento sarà istantaneo.
Diagramma termodinamico ( p, T )
Proiettiamo ora il nostro diagramma nell’altra dimensione, quella del volume specifico. In questo caso riusciamo ad individuare alcune grandezze importanti, in particolar modo un punto detto Punto Triplo, proiezione della retta abd del diagramma tridimensionale. Definiamo il punto triplo come l’unico punto del diagramma termodinamico in cui sussistono contemporaneamente tutte e tre le fasi. Dalla regola di Gibbs è il luogo in cui P = 0 cioè dove non si ha alcun grado di libertà.
Nel punto triplo la temperatura vale 0,01 °C e la pressione 611 Pascal; essendo una pressione molto bassa e l’ambiente molto rarefatto, è una situazione tipica da laboratorio, impossibile nella realtà quotidiana.
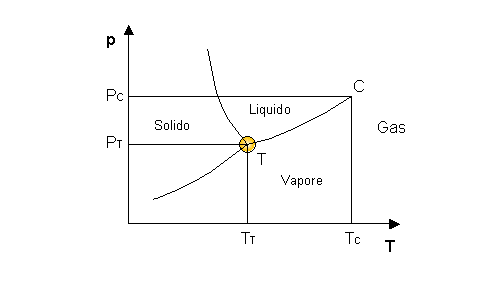
Fig.6 Diagramma ( p,T ) in cui è evidenziato il Punto Triplo
Dal grafico notiamo che all’aumentare della pressione il passaggio di stato Solido-Liquido dell’acqua, contrariamente a quanto succede per la maggioranza delle altre sostanze, avviene a temperature sempre inferiori. Consideriamo ad esempio un filo portante all’estremità due pesi e appoggiato su un blocco di ghiaccio a temperatura inferiore allo 0 ( Fig. 7.1 ). A causa della pressione esercitata dal filo si ha un abbassamento della temperatura di fusione nella zona sotto pressione, e il filo inizia a penetrare nel blocco. Nei punti già attraversati dal filo la pressione diminuisce considerevolmente e il blocco si risolidifica ( Fig. 7.2 ). In questo modo il filo è in grado di attraversare tutto il blocco senza comunque dividerlo ( Fig. 7.3 ).
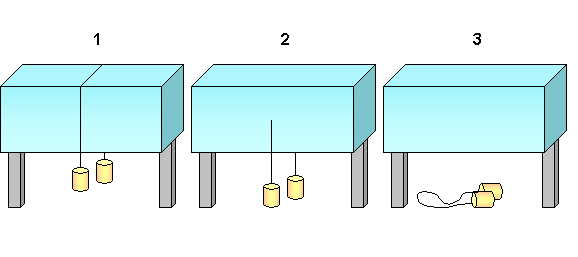
Fig. 7.1, 7.2, 7.3 schema esplicativo dell’esperienza.