
Professore:
Data
e Ora della Lezione:
17/11/2000
dalle 8.30 alle 10.30
Sassi
Zanichelli Emanuele
n°132575
Ci troviamo in presenza di uno “scatolone” realizzato con un involucro perfettamente isolante. Dato questo alto fattore di isolamento possiamo considerare nulla la quantità di calore Q scambiata tra l’interno e l’esterno del recipiente in questione. Il recipiente ha un volume complessivo V costante ed è diviso da un setto trattenuto da un fermo meccanico in due parti chiamate a e b.

Figura 1
In a è contenuto una massa Ma di vapore saturo d’acqua pari ad 1 kg alla Pressione Pa = 9,8 bar e titolo Xa = 0,1. E’ inutile assegnare anche la temperatura Ta dal momento che sappiamo che, per i vapori saturi, ad ogni pressione corrisponde una e una sola temperatura fratta le tabelle del vapore. Nello stato fisico b, invece ,la massa di vapore saturo di acqua è Mb = 2 kg mentre la pressione Pb = 0,98 bar e il Titolo Xb = 0,5. Anche in questo caso la temperatura Tb la ricavo dalle tabelle.
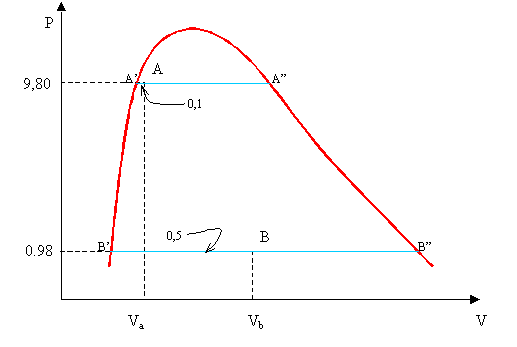
Tabella 1 - Diagramma P V del Vapore Saturo.
Graficamente A si trova ad un decimo di distanza dal primo estremo del segmento A’A” staccato dalla curva sulla retta a pressione costante Pa = 9,8 bar mentre B (che ha pressione Pb e temperatura Tb inferiori) con Xb = 0,5 si troverà sulla metà del segmento B’B”.
Il mio sistema è in equilibrio o meglio le due sottoparti sono localmente in equilibrio, ma se io tolgo il setto il sistema non è più in equilibrio perché abbiamo due pressioni diverse e due temperature diverse. I due gas si mescoleranno, il gas condenserà, il liquido evaporerà non sappiamo cosa accadrà in questo rapido transitorio nel quale avvengono queste trasformazioni ma alla fine il sistema tornerà ad uno stato di uniformità delle proprietà nei termini di tutto il sistema: si stabilisce un nuovo stato di equilibrio finale detto C.

Figura 2
Questo stato di equilibrio finale C non si troverà sulla congiungente A e B perché le trasformazioni che riguardano i vapori saturi non hanno caratteri della linearità quindi non posso fare un’interpolazione lineare tra A e B (tirare una retta dividerla in n parti e prenderne n-m). Il sistema non è governato, come nei gas perfetti, da un’equazione semplice e lineare ma ha un comportamento alquanto complicato non descrivibile tramite un’equazione ma tramite tabelle. In conseguenza di ciò è difficile ottenere da un calcolo, inteso nel senso algebrico del termine, il risultato del mio problema ovvero quale sarà lo stato fisico finale.
Quando tolgo il setto, la termodinamica interna, avendo delle leggi ferree, in un certo senso, blocca in maniera inequivocabile lo stato fisico finale, ma, contemporaneamente, alcune di queste sfuggono alla valutazione formulistica basata su equazioni, formule di calcolo, quindi io non riesco sempre a determinare lo stato fisico finale semplicemente scrivendo:
![]()
Questo è vero per la maggior parte dei problemi tecnici per cui non esiste la soluzione analitica “il formulino” risolutivo. Procedendo quindi a tentativi è fondamentale avere una tabella “raffinata” ovvero con tante righe ed ogni riga poco spaziata dalla successiva: così facendo si ottiene un errore minore. Tra tutte le righe della tabella dovrò individuare quella su cui si trova il valore più vicino allo stato fisico finale.
Lo stato fisico in termodinamica è definito da due coordinate termodinamiche:
![]()
Sia Tc che Pc indicano in maniera univoca una riga della tabella. Questo ancora non mi definisce lo stato fisico finale perché sappiamo che per ogni riga della tabella abbiamo molteplici valori quindi ci serve una seconda coordinata che mi indichi in modo definitivo la soluzione: il Titolo finale.
![]()
A questo punto abbiamo una sorta di “Parco Equazioni” dal quale attingere: i due principi della termodinamica (anche se nel 99,9% dei casi usiamo solo il primo):
Principio di Conservazione dell’energia.
Principio di Conservazione della Massa (vedi esercizio precedente sul miscuglio di Idrogeno e Ossigeno: usata per determinare la composizione percentuale del miscuglio che ero andato a creare).
In alcuni casi posso utilizzare una terza grandezza: il Volume, perché il nostro sistema (che è chiuso) ha un volume fissato V = costante.
![]()
In questo caso non utilizziamo la Conservazione della Massa perché la soluzione a cui porta è talmente ovvia e banale che non è di nessun aiuto al fine della risoluzione del problema. Nel caso in questione ho dell’Acqua in a e Acqua in b quindi se le mischio ottengo ancora Acqua quindi farò in modo di usare questa equazione implicandola nelle altre due.
![]()
dove:Uc è l’energia finale;Ua è l’energia in a; Ub è l’energia in b. Vc è il volume finale;Va è il volume in a; mentre Vb è il volume in b.
Riscrivo le due equazioni precedenti implicando la conservazione della massa:
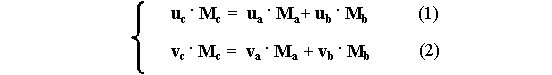
dove:uc è l’energia interna specifica finale; ua è l’energia interna specifica in a; ub è l’energia interna specifica in b. vc è il volume specifico finale;va è il volume specifico in a; mentre vb è il volume specifico in b. Ma, Mb, Mc sono le tre masse.
La soluzione del sistema precedente determinerà le mie due incognite: uc e vc.
u e v si trovano sfruttando le formule:
![]()
dove:ul è l’energia specifica del liquido, x è il titolo, r è il calore latente di vaporizzazione, P è la pressione e vd volume differenziale. Questi valori si reperiscono dalle tabelle.
Svolgendo i calcoli ottengo:
ua = 759 + 0,1 . (2018 – 981 . 0,1969) = 941 kJ / kg
ub = 415 + 0,5 . (2259 – 98,1 . 1,724) = 1460 kJ / kg
![]()
dove: vl è il volume specifica del liquido, x è il titolo vd volume differenziale. Anche in questo caso i valori si ricavano dalla tabella.
va = 0,001126 + 0,1 . 0.1969 = 0,0208 m3 / kg
vb = 0,001043 + 0,5 . 1,724 = 0,8630 m3 / kg
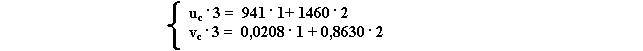
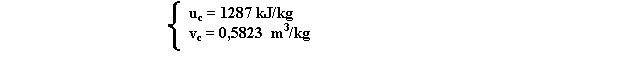
in questo caso ora il volume finale è la media pesata dei volumi di partenza.
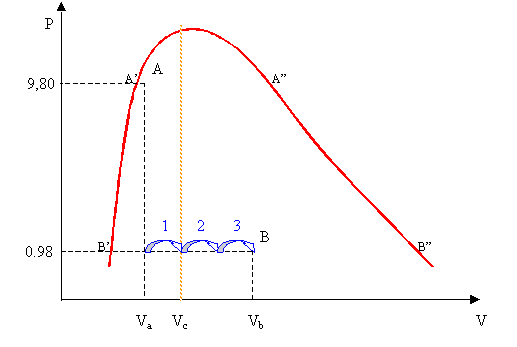
Tabella 2 - Diagramma P V del Vapore Saturo.
Questo significa che io prendo il segmento che va da Va a Vb , lo divido in 3 parti uguali, considero la prima delle tre parti e vado a disegnare la retta verticale a volume costante Vc ma mancandomi ancora la pressione o la temperatura non so a quale punto della retta corrisponderà il mio punto C.
Conoscendo il valore di due grandezze, usando le tabelle cerco le grandezze tabellate
Procedimento:
1) scelgo una riga della tabella
2) uso i valori della tabella per ricavare Xc
3) il valore Xc trovato nella seconda equazione va sostituita nella prima ottenendo uc*
4) confronto uc* con uc
questo procedimento va fatto fintanto che non si trova la soluzione più vicina
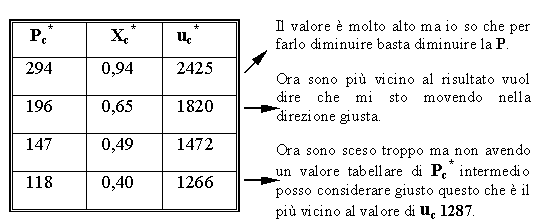
Il Risultato è :
Pc
= 1,18 bar
Xc
= 0,40
OVVIAMENTE questo metodo non ha senso per problemi che sono fisicamente indeterminati cioè se il numero di condizioni fisiche non è sufficiente a definire in modo univoco il risultato.
ESERCIZIO 2
In questo esercizio andremo a misurare il titolo Xv del vapore acqueo.
Quando noi abbiamo un vapore che circola in un condotto o è dentro un recipiente dall’esterno non è possibile valutarne il titolo.
A questo punto abbiamo due metodi a seconda della pressione a cui si trova il vapore:
1° Valido per Vapori alla Pressione atmosferica.
2° Valido
per Vapori in pressione.
Dal recipiente che contiene il vapore ne faccio uscire una piccola quantità e la faccio convogliare in un calorimetro pieno d’acqua.
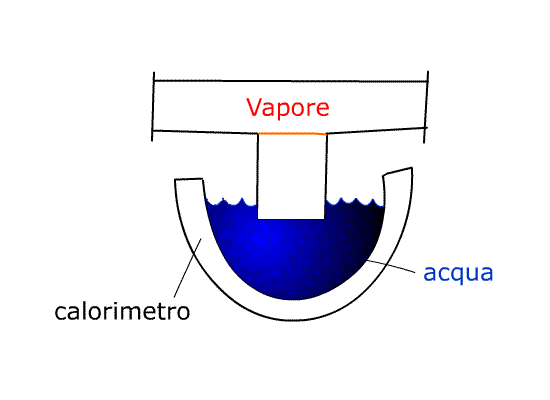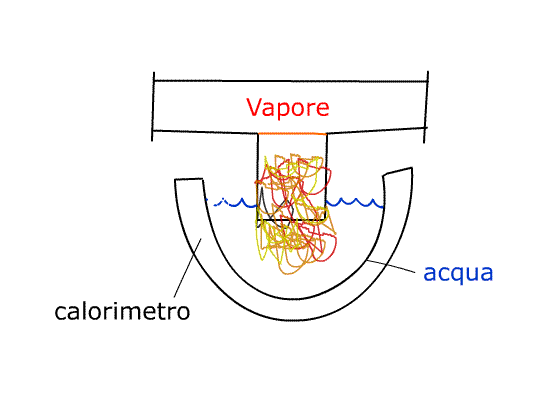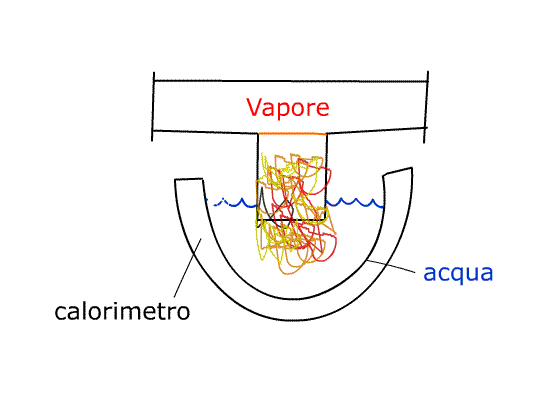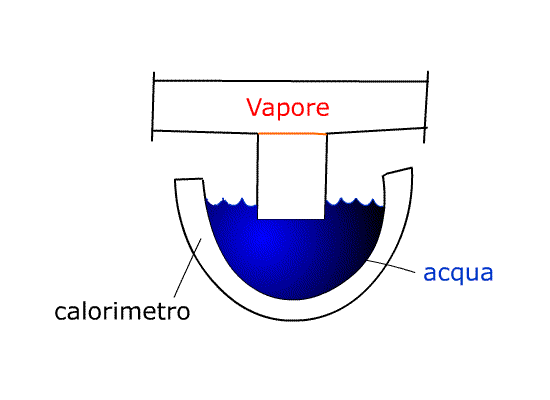
Il CALORIMETRO è una specie di grosso “termos”, un vaso di vetro doppio con la superficie che da sulla cavità vuota al suo interno a specchio. Questo espediente riduce lo scambio termico con l’esterno cosicché l’isolamento è pressoché perfetto. Questo funziona solo con vapore alla pressione ambientale (atmosferica). I dati tecnici del calorimetro sono riportati sul fondo del calorimetro stesso:
-costruttore e luogo di costruzione;
-durata prevista (dopo la data indicata è consigliabile sostituire il calorimetro perché non è più garantito l’isolamento);
-equivalente in acqua che il calorimetro può contenere (mi indica la capacità termica del mio calorimetro: in questo caso è pari alla capacità termica di 0,220 kg di acqua)
Quindi, andando a scrivere il bilancio dell’energia di questo sistema, è come se la massa effettiva contenuta al suo interno non fosse di 0,350 kg ma di 0,570 kg, perché è come se avessi aggiunto una quantità “virtuale” d’acqua rappresentata dalle pareti del nostro calorimetro.
La massa iniziale dell’acqua contenuta nel calorimetro è Min = 0,350 kg
Andando a pesare in un momento successivo noteremo che la massa finale Mfin è maggiore di quella iniziale perché vi si è aggiunta la massa del vapore che condensando sul calorimetro va ad aumentare la massa d’acqua.
![]()
La massa non è l’unico aspetto che si modifica, anche la temperatura risulta incrementata:
![]()
Queste sono le informazioni dalle quali devo ricavare il titolo che aveva il vapore. Noi inoltre sappiamo che quando il vapore si trovava nel tubo aveva la pressione P = 1 bar e quindi la temperatura T = 100°C quindi sicuramente il
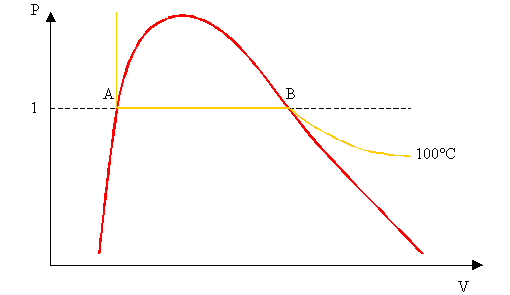
Tabella 3
- Diagramma P V del Vapore saturo.
valore del mio titolo si troverà sul tratto orizzontale
AB della funzione rappresentata nella Tabella 3 in arancione ma non so
ancora in quale punto.
ATTENZIONE: questo metodo vale solamente per vapori a pressione ambientale; per vapori a pressione superiore vedremo un nuovo esempio successivamente.
L’equazione che devo scrivere a questo punto è quella del bilancio energetico però nel mio sistema ho che la massa varia infatti la mia massa finale è diversa dalla massa iniziale.
Come si esprime questo nell’equazione del
bilancio energetico?
Quando scriviamo il primo principio:
-per i sistemi chiusi: il salto di energia interna è uguale al calore del mio lavoro
-per i sistemi aperti: bisogna utilizzare il salto di entalpia (è il nostro caso!!!)
![]()
Ora dobbiamo però valutare che avendo un sistema fisico isolato non avviene alcuno scambio di calore quindi Q = 0 inoltre non è applicata nessuna macchina (pompa; turbina…) quindi non sono neanche in presenza di un lavoro: L = 0

a questo punto posso riscrivere la definizione precedente come:
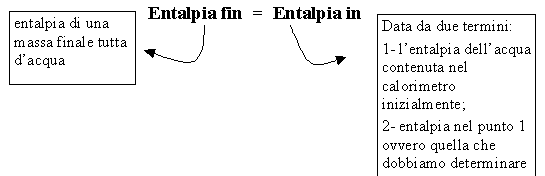
![]()
Dove Hfin = Mfin,tot .
C1 . Tfin
Hin =
Min,tot . Cl
. Tin + (Mr . h)
Mfin,tot
. C1 . Tfin
= Min,tot .
Cl . Tin + (Mr .
h)
Mfin,tot
. Cl . Tfin
= Min,tot .
Cl . Tin + Mv . (hl
+ Xv)
![]()
Min,tot :acqua all’interno del calorimetro addizionata dell’
equivalente in acqua del
calorimetro
Mfin,tot : è compreso l’equivalente in acqua del calorimetro
Cl : calore specifico del liquido
Mv :massa del vapore che doveva ancora
fluire fuori e che si trovava ad una ben
determinata entalpia specifica h
hl : entalpia del liquido
r :calore latente a 100°C
sostituiamo i valori numerici:
(0,395 + 0,220).4,187.64 = (0,220 +
0,350).4,187.25 + 0,045. (4,187.100
+ Xv . 2257)
R: Xv
= 0,85
ESERCIZIO 3
Ora osserviamo cosa succede nel caso
in cui il vapore abbia un pressione di molto superiore a quella atmosferica.
Naturalmente non si riesce a farlo fluire lentamente perché la differenza di
pressione tra i due ambienti la farebbe passare rapidamente da quello con
pressione maggiore a quello con pressione minore. Come abbiamo visto per l’esempio della pompa della
bicicletta, una trasformazione molto rapida è una trasformazione ADIABATICA
nella quale sicuramente Q2
= Q1. Altra cosa che possiamo dire è che non è stato fatto
alcun Lavoro (in realtà il vapore
fuoriuscendo ha acquisito una certa velocità, quindi una certa energia cinetica
- un po’ di lavoro è stato fatto – TUTTAVIA, rispetto alle quantità di
calore in gioco, con relazione al calore latente di vaporizzazione o al calore
specifico dell’acqua o del vapore, è dopotutto trascurabile).
Siamo davanti ad una trasformazione senza scambio di
Calore e senza scambio di Lavoro MA fortemente irreversibile quindi NON POSSO
USARE la formula

Cosa succede in questo caso?
L’entropia è
cambiata radicalmente. Questo è ben visibile dalla Tabella 4: il punto 1
si trova all’interno della curva mentre il punto 2 è all’esterno. E’
rimasto costante invece il bilancio dell’Energia perché sappiamo che esso
prescinde dal fatto che la trasformazione sia reversibile o irreversibile ma
essendo ancora una volta in presenza di un sistema aperto non dovrò uguagliare
l’Energia interna ma l’Entalpia (trasformazione
ISOENTALPICA) quindi avrò che:
![]()
I dati a mia disposizione sono: la pressione data dal manometro posto
sulla tubatura P1 = 39,77 bar. Avendo la pressione
dalla tabella, posso ricavare la
T1 = 250°C. Aprendo la valvola di sfogo della
mia tubatura e avvicinando al getto di vapore un termometro a mercurio posso
avere la temperatura all’esterno T2 del mio vapore alla
pressione atmosferica P2 = 1bar. Lo sfiato dura finchè
il sistema non va a regime anche perché il termometro a mercurio necessita di
un certo tempo per misurare la temperatura. Così facendo misuro la temperatura
di T2 = 115°C.
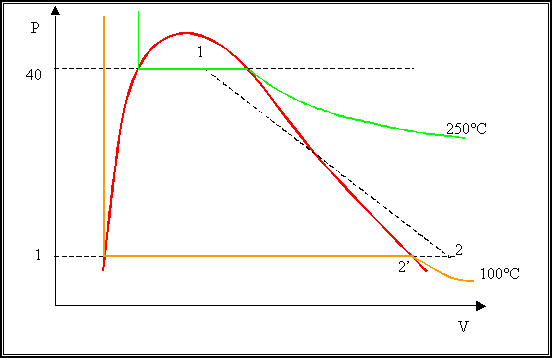
Tabella
4 -
Diagramma P V del Vapore saturo.
Ma l’uguaglianza tra Entalpie complessive può essere
trasformata nell’uguaglianza tra entalpie specifiche:

Poiché questo sistema è a regime
stazionario, per cui, per ogni kg
che entra un kg esce, avremo che M1
= M2
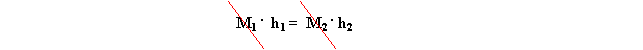
allora h1 = h2
Come si scriveranno le due entalpie specifiche?
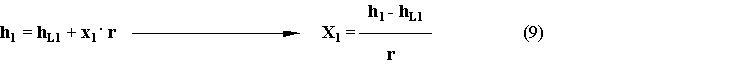
hL1: entalpia del liquido in 1 (dalle tabelle);X1 incognita;
r valore tabellato
![]()
CPV: calore specifico del vapore
(T2 – T2’) : salto di
temperatura; T2’ =100°C perché si trova sulla curva
Tcost = 100°C
Svolgendo i calcoli dell’uguaglianza tra le Entalpie
specifiche ottengo:
4,187 . 100 + 2257 + 1,95 . (115 – 100) = 2705
kJ / kg
ora posso determinare X1:

Il vapore che circola in queste condutture ha quindi un
titolo piuttosto alto inadatto per turbine che prediligono il cosiddetto vapore
saturo secco privo di quelle goccioline che potrebbero danneggiare la macchina;
potrebbe essere il caso invece delle macchine usate nelle centrali Enel:
macchina Renkin.
ESERCIZIO 4
In questo esercizio devo calcola qual’è la quantità di calore necessario per produrre 1 kg di vapore. La caldaia produce vapore surriscaldato (ottimo per essere mandato in turbina perché data la temperatura esce privo di goccioline d’acqua).
UTILIZZO: sterilizzazione, pastorizzazione….
Il sistema ha una pressione al suo interno di P1
= 40 bar
La temperatura dell’acqua liquida in entrata nella
caldaia è di T1 = 60°C
La temperatura del vapore surriscaldato in uscita è di T2
= 300°C
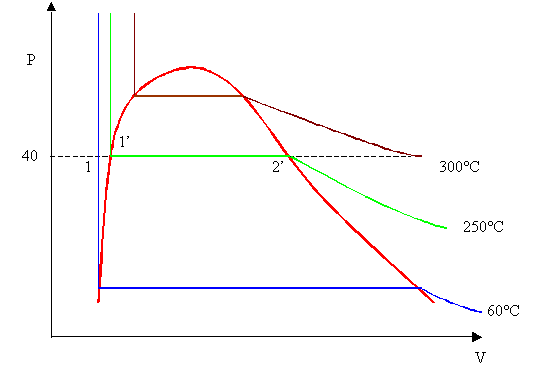
Tabella 5 - Diagramma P V del Vapore saturo.
Ancora una volta ho un sistema aperto : consideriamo la situazione a regime per cui per ogni kg di acqua che entra nella caldaia esce un kg di vapore.
Scriviamo ancora una volta il bilancio dell’energia:
![]()
la quantità di calore non l’abbiamo, essendo il dato che dobbiamo trovare; il lavoro all’interno del nostro sistema è L = 0 visto che non ci sono macchine ( per esempio Pompe) all’interno della caldaia. Riscriviamo il Bilancio Energetico

![]()
r calore latente di vaporizzazione alla
temperatura T = 250°C
Cpv il calore specifico del vapore è di 2,1
Q = 4,187 . (250 - 60) + 1713 +2,1 . (300 - 250) = 2614 kJ